Abstrak
Asam urat adalah produk akhir metabolik dari metabolisme purin pada manusia. Ia memiliki sifat-sifat antioksidan yang mungkin melindungi tapi dapat juga menjadi pro-oksidan, bergantung pada lingkungan mikro kimianya. Hiperurisemi merupakan predisposisi penyakit lewat pembentukan kristal urat yang menyebabkan gout, tapi hiperurisemi, tidak bergantung dari pembentukan kristal, juga telah dihubungkan dengan hipertensi, atherosklerosis, resistensi insulin, dan diabetes. Didiskusikan di sini biologi metabolisme urat dan perannya dalam penyakit. Juga tentang genetika transpor urat, termasuk URAT1, dan kajian terkini pengidentifikasian SLC2A9, yang mengkode keluarga transpor glukosa isoform Glut9, sebagai sebuah determinan major level asam urat plasma dan perkembangan gout.
Pendahuluan
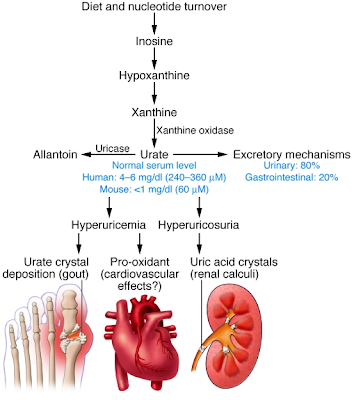
Asam urat, asam organik lemah dengan pKa 5.75, hadir utamanya sebagai monosodium urat (MSU) pada nilai pH fisiologis. Pada mana dalam tubuh manusia dan kera besar, asam urat merupakan produk akhir degradasi purin, pada mamalia lainnya, ia selanjutnya didegradasi menjadi alantoin oleh urikase, enzim yang kebanyakannya ditemui dalam hati. Gen yang mengkode urikase mengalami pembungkaman mutasi selama evolusi hominid (1). Konsekuensi inaktifasi urikase adalah penampakan level urat yang lebih tinggi pada manusia (≈240-360 μM) dalam perbandingannya dengan mamalia lainnya (≈30-50µM pada tikus kecil). Telah diusulkan bahwa level serum urat yang lebih tinggi mungkin merupakan keuntungan selektif dalam evolusi hominid karena efek antioksidannya. Di lain pihak, hiperurisemi dikaitkan dengan penyakit berganda pada manusia dan menunjuk ke pada efek merugikan dari konsentrasi urat tinggi (Gambar 1). Di sini, ditinjau informasi yang tersedia mengenai peran dari asam urat sebagai anti- atau pro-oksidan, terhadap hubungan epidemiologi di antara hiperurisemi dengan penyakit, dan terhadap mekanisme molekuler dari transpor urat ginjal.
Gambar 1
Jalur homeostasis urat
Skema simpulan dari jalur-jalur untuk menghasilkan asam urat, untuk membaliknya menjadi alantoin oleh enzim hati urikase, dan untuk mengekskresinya. Keseimbangan di antara jalur-jalur ini mengatur konsentrasi urat darah, yang mana adalah lebih tinggi pada manusia dan kera besar akibat dari inaktifasi gen-gen urikase. Hiperurisemi dapat menyebabkan gout dan mungkin berbagai efek kardiovaskuler, di mana hiperurikosuri dapat menyebabkan bermacam patologi terinduksi-kristal asam urat.
Konsekuensi klinik hiperurisemi
Epidemiologi gout dan hiperurisemi
Terdapat bukti epidemiologi kuat bahwa prevalensi gout dan hiperurisemi dalam keadaan meningkat di seluruh dunia. Gout merupakan penyakit yang mengenai utamanya pria, dengan sebuah peningkatan yang jelas dalam prevalensi di kedua jenis kelamin dengan menuanya usia, dan disebabkan oleh deposisi jaringan dari kristal urat yang menimbulkan sebuah reaksi inflamasi yang dapat sembuh sendiri yang intens. Kaitan epidemiologi di antara hiperurisemi dengan gout dimapankan lebih dari 150 tahun lalu (2, 3). Kajian baru-baru ini memerlihatkan satu peningkatan prevalensi gout, khususnya pada kelompok usia lebih tua. Dalam sebuah kajian di Amerika, prevalensi berlipat ganda dalam populasi usia di atas 75 tahun antara tahun 1990 dan 1999, dari 21 per 1,000 ke 41 per 1,000 (4). Dalam kajian kedua, prevalensi gout pada populasi dewasa di Inggris diperkirakan sebesar 1.4%, dengan puncaknya lebih dari 7% pada pria usia di atas 75 tahun (5). Kecenderungan ini juga telah diamati dalam kajian pada negara-negara berkembang di Asia (6, 7). Walaupun kajian memusatkan pada gout, disimpulkan bahwa insiden hiperurisemi telah juga meningkat dalam periode yang sama. Penjelasannya yang potensiil untuk semua temuan ini meliputi gaya hidup dan perubahan diet yang disebabkan oleh meningkatnya kesejahteraan, meningkatnya harapan hidup, meningkatnya penggunaan agen-agen hipertensif, juga penuaan dari keseluruhan populasi.
Hiperurisemi, resistensi insulin, hipertensi, dan penyakit kardiovaskuler
Hiperurisemi merupakan temuan umum pada pasien-pasien dengan sindrom metabolik (8), dan sebuah korelasi terbalik tercatat di antara resistensi insulin dengan menurunnya kliren asam urat ginjal, yang itu sendiri dikaitkan dengan urikemi meningkat (9). Kegemukan, khususnya adipositas viseral, adalah juga secara positif dikaitkan dengan hiperurikemi, yang dapat dikurangi dengan penurunan berat badan (10-12), Hiperurisemi juga seringkali teramati pada pasien-pasien dengan penyakit kardiovaskuler. Pertanyaan apakah hiperurisemi adalah sebuah faktor risiko independen untuk penyakit kardiovaskuler telah diajukan lebih dari lima dekade lalu (13). Akhir-akhir ini, timbul minat baru dalam hiperurisemi dan hubungannya dengan hipertensi dan mortalitas kardiovaskuler, dan kajiannya menyarankan bahwa memang mungkin memiliki efek vaskuler langsung (14, 15). Pada anak-anak hipertensif dengan fungsi ginjal normal, terdapat korelasi kuat di antara hiperurisemi dengan tekanan darah (16), dan dalam sebuah percobaan terkontrol, pengobatan subjek-subjek ini dengan penghambat xanthine oxidase alopurinol secara bermakna menurunkan tekanan darah dalam satu kajian jangka pendek (17). Dalam 20 tahun terakhir, lebih dari 10 kajian melaporkan bahwa hiperurisemi merupakan sebuah faktor risiko independen bagi perkembangan hipertensi (14).
Kajian epidemiologi telah juga mengevaluasi hubungan antara hiperurisemi dengan penyakit kardiovaskuler. Dalam kohort Framingham, para penyelidik menyimpulkan bahwa hiperurisemi adalah sebuah kovariabel dari faktor risiko kardiovaskuler yang telah dikenal lainnya bagi kematian jantung dan penyakit jantung koroner (18). Yang lebih terkini, data tampaknya mengayunkan interpretasi dengan cara lain, yang mengindikasikan bahwa hiperurisemi mempredisposisi pembentukan plak dan disfungsi endhotel, sebagaimana dinilai dengan ultrasonografi (19-21). Hiperurisemi juga dilaporkan menjadi satu faktor risiko independen untuk mortalitas kardiovaskuler (22-23). Pada pasien dengan penyakit kardiovaskuler yang telah mapan, meningkatnya level urat merupakan sebuah prediktor independen dari kejadian kardiovaskuler (24); dan akhirnya, dalam satu analisis-meta dari hubungan antara hiperurikemi dan stroke, satu risiko kecil tapi meningkat dijumpai bahkan setelah pencocokan untuk faktor risiko kardiovaskuler yang telah dikenal (25). Dalam kebanyakan kajian, risiko meningkat hiperurisemi untuk morbiditas kardiovaskuler (dengan odds ratio atau hazard ratio) adalah sekitar 1.2-1.4.
Bila hiperurisemi merupakan satu faktor etiologi dalam morbiditas kardiovaskuler, apakah mekanismenya, dan akankah modifikasinya memengaruhi hasil luaran? Data dari sebuah model binatang pengerat menyarankan bahwa vasokonstriksi bermediasikan-asam urat menyebabkan disfungsi endotel, aktivasi sistim renin-angiotensin, dan hipertensi (26). Kritik, bagaimanapun, akan mendebat bahwa adalah memungkinkan untuk menguraikan hiperurisemi dari hipertensi dan bahwa hiperurisemi merupakan sebuah penanda pengganti untuk disfungsi renal subklinik dini, dan komplikasi kardiovaskuler adalah sekunder. Dalam ketiadaan data eksperimental yang meyakinkan, debat ini hanya bisa diselesaikan oleh kajian intervensi berskala-besar dalam sebuah populasi hiperurisemi guna menganalisis efek terhadap tekanan darah dan kejadian-kejadian kardiovaskuler di sepanjang waktu.
Asam urat: antioksidan ataukah pro-oksidan?
Hiperurisemi relatif pada manusia telah memunculkan pertanyaan sekitaran keuntungan evolusionernya, dan hubungannya dengan penyakit membutuhkan pemahaman bagaimana ia dapat menjadi merusak pada konsentrasi tinggi. Awalnya, asam urat dipertimbangkan sebagai produk limbah lembam yang mengkristal pada konsentrasi tinggi membentuk batu ginjal dan membangkitkan artritis gout. Selanjutnya, asam urat dikenal sebagai sebuah antioksidan kuat yang mencari-cari (scavenge) oksigen tunggal, radikal oksigen, dan peroksinitrit dan metal transisi kelat dalam limbah metabolisme untuk mengurangi, umpamanya, oksidasi asam askorbat bermediasikan-ion besi. Urat dengan begitu menyumbang bagi sedikitnya setengah dari kapasitas antioksidan dari plasma manusia, dan sifat antioksidannya adalah sekuat asam askorbat (27, 28). Sebagaimana diilustrasikan dalam Gambar 2A, asam urat dapat mencegah nitrosasi protein terinduksi-peroksinitrit, peroksidasi lemak dan protein (30), dan inaktifasi tetrahidrobiopterin (31), sebuah kofaktor yang perlu untuk NOS. Asam urat juga melindungi LDL dari oksidasi bermediasikan-Cu2+ (Gambar 2B). Bersama-sama, semua aksi antioksidan ini mendasari efek perlindungan dari aksi asam urat pada penyakit kardiovaskuler, penuaan, dan kanker (27).
Gambar 2
Efek anti-oksidan dan pro-oksidan dari asam urat
Aktifitas antioksidan. (A) Peroksinitrit (ONOO–) dihasilkan dari reaksi oksida nitrit (NO•) dengan superoksid (O2–•). Peroksinitrit dapat menginduksi nitrosasi protein dan peroksidasi lipid dan protein dan mengeblok tetrahidrobiopterin (HB4), sebuah kofaktor penting untuk aktifitas NOS. Dalam ketiadaan HB4, NOS menghasilkan ROS. Asam urat (UA) dapat secara langsung menginaktifasi peroksinitrit dengan satu reaksi yang membangkitkan radikal asam urat (UA•); semua ini dapat dengan cepat dieliminasi oleh asam askorbat plasma. (B) Asam urat dapat juga mencegah oksidasi terinduksi-Cu2+ oleh LDL, sebuah reaksi yang dapat melindungi terhadap perkembangan atherosklerosis. (C) Melalui penguatan aktifitas arginase, asam urat mengalihkan l-arginin dari produksi NO ke produksi urea. Asam urat dapat juga secara langsung bereaksi dengan NO untuk membangkitkan asam urat ternitrosasi, dan kelompok nitroso kemudian dapat ditransfer ke glutathion (GSH) untuk tranpor ke molekul penerima lain. Dalam kehadiran oksigen, asam urat bereaksi dengan NO untuk menghasilkan spesies stabil 6-aminourasil. Penyerapan asam urat dalam adiposit mengaktifasi NADPH oksidase dan meningkatkan produksi ROS, yang mana dapat memulakan satu reaksi inflamasi. Dalam sel-sel otot polos pembuluh darah, asam urat dapat mengaktifasi jalur NF-κB dan MAPK dan meningkatkan siklooksigenase dan produksi MCP-1. Panah biru, reaksi kimia; panah hijau, produk-produk dari jalur enzimatik atau jalur pensinyalan; panah merah, aktifasi aktifitas enzimatik.
Namun, kajian in vitro dan seluler telah menunjukkan bahwa bergantung pada lingkungan mikro kimianya, asam urat juga dapat menjadi pro-oksidan. Umpamanya, walaupun asam urat dapat melindungi partikel LDL alami melawan oksidasi terinduksi-Cu2+, ia juga meningkatkan oksidasi dari LDL yang telah mengalami oksidasi, yang mengandung produk peroksidasi lemak (32, 33), dan dua peran ini muncul tergantung pada kehadiran metal transisi. Sebagaimana diilustrasikan dalam Gambar 2A, ketika asam urat dioksidasi oleh peroksinitrit, radikal urat dihasilkan yang dapat menyebarluaskan keadaan pro-oksidan (34), tapi dalam plasma, mereka dengan cepat diinaktifasi oleh reaksinya dengan asam askorbat (31).
NO, yang pada awalnya dijelaskan sebagai sebuah faktor merelaksasi berasal-sel endothel, adalah sebuah molekul pengaturan penting dalam sistim kardiovaskuler, dan berkurangnya level NO dikaitkan dengan hipertensi dan resistensi insulin (35-37). Urat dapat bereaksi secara langsung dengan NO di bawah kondisi aerob untuk membangkitkan satu hasil asam urat ter-nitrosasi tak stabil yang dapat memindahkan NO ke molekul lain seperti glutathion (ref. 38 dan Gambar 2). Di bawah kondisi anaerob, urat dikonversikan dalam kehadiran NO menjadi 6-aminourasil stabil (39). Kemungkinan bahwa level plasma urat meningkat dapat menurunkan ketersediaan hayati NO telah diujikan pada tikus besar yang diobati dengan penghambat uricase asam oksonat. Konsekuensi meningkatnya asam urat plasma memang terkait dengan menurunnya nitrit/nitrat (NOx) plasma. Hal yang sama, paparan langsung sel endotel dengan asam urat sedikit mengurangi produksi NO basal atau yang terstimulasi-VGF (40). Jadi, asam urat dapat mengurangi ketersediaan hayati NO yang bergantung-dosis. Walaupun sebuah reaksi kimia langsung urat dengan NO dapat menjelaskan menurunnya NOx plasma, terdapat bukti bahwa urat in vivo dapat mengurangi produksi NO dengan gangguannya pada biosintesisnya. Umpamanya, pada sel-sel endotel paru, asam urat menurunkan produksi NO dengan sebuah mekanisme yang bergantung pada asam urat meningkatkan aktifitas arginase, yang mengalihkan l-arginin ke produksi urea alih-alih ke produksi NO oleh eNOS (Gambar 2C dan ref. 41).
Aksi pro-oksidan lainnya dari urat telah dijelaskan selama diferensiasi adipogenik sel 3T3-L1 (Gambar 2). Ketika semua sel ini diinduksi untuk berdiferensiasi menjadi adiposit, penambahan asam urat pada konsentrasi fisiologis lebih jauh meningkatkan produksi ROS melalui satu mekanisme yang melibatkan aktifasi oksidasi NADPH (42). Efek ini dalam adiposit mungkin berpartisipasi dalam induksi inflamasi dan resistensi insulin jaringan lemak yang teramati pada kegemukan (43). Dalam sel otot polos vaskuler, asam urat telah dilaporkan merangsang produksi MCP-1 mengikuti aktifasi NF-κB, MAPKs, dan siklooksigenase 2 (44).
Bersama-sama, informasi yang tersedia mengindikasikan bahwa asam urat memiliki efek kimia dan biologi kompleks dan bahwa sifat-sifat pro-oksidan atau menurunkan-NO nya mungkin menjelaskan hubungan di antara hiperurisemi, hipertensi, sindrom metabolik, dan penyakit kardiovaskuler (45). Tambahannya, ketika hiperurisemi menyebabkan pembentukan kristal mikro, ia menimbulkan inflamasi sendi dan ginjal. Inflamasi kronik (sebagaimana dalam gout dengan banyak tofus) menyebabkan destruksi tulang dan kartilago, dan hiperurisemi kronik dan hiperurikosuri pada pasien gout adalah juga seringkali dikaitkan dengan fibrosis tubulointerstisiil dan glomerulosklerosis, tanda dari inflamasi ginjal lokal (46). Bagian dari ini dijelaskan dengan aktifasi dari inflamasom NALP3 untuk memroses dan menyekresi IL-1β (47), tapi jalur lain inflamasi telah juga diunjukkan (47-49).
Tidak terdapat penjelasan sederhana untuk efek perlindungan atau patogenik yang mungkin dari hiperurisemi, dan terdapat kebutuhan lebih banyak lagi model hewan untuk pengkajian tautan ini.
Protein mentranspor-urat dan genetika patologi pentranspor urat
Homeostasis urat bergantung pada keseimbangan di antara produksi dan proses kompleks sekresi dan reabsorpsi dalam tubulus ginjal dan ekskresi dalam usus halus. Diperkirakan bahwa sedikitnya 30% ekskresi asam urat adalah oleh usus halus dengan mekanisme yang sejauh ini belum diselidiki secara rinci. Mekanisme ginjal dari ekskresi urat lainnya adalah sebesar 70% dan merupakan kunci untuk memahami hiperurisemi. Pada pasien yang memerlihatkan gout dan hiperurisemi primer, mayoritasnya adalah urat ekekresi rendah ketika klirens fraksi urat diukur (50). Transpor urat oleh ginjal telah diselidiki selama bertahun-tahun, sebagiannya untuk mencari obat urikosurik dalam menurunkan level urat plasma. Selama ini, beberapa klas obat urikosurik telah diidentifikasi menurunkan level urat plasma, seperti misalnya, benzbromaron, probenesid, sulfinpirazon, atau losartan, di mana agen-agen farmakologi lainnya seperti misalnya pirazinoat, metabolit aktif pirazinamid, nikotinat, dan laktat, adalah antiurikosurik.
Dalam ginjal manusia, penanganan urat melibatkan filtrasi glomerular urat diikuti oleh sejajaran kompleks dari mekanisme reabsorptif dan sekretori yang terjadi di tubulus proksimal. Pada tikus kecil, tubulus proksimal maupun tubulus konvulasi distal tampaknya terlibat dalam reabsorpsi dan sekresi urat, sebagaimana ditentukan oleh lokalisasi dari bermacam pembawa urat yang didiskusikan di bawah dan digambarkan dalam Gambar 3. Harus dicatat bahwa kepentingan relatif dari mekanisme reabsorpsi dan sekresi berbeda di antara spesies. Manusia, tikus kecil, dan tikus besar terutama menyerap kembali asam urat, pada mana babi, kelinci, reptil, dan burung memiliki lebih aktif mekanisme sekretori.
Gambar 3
Pentranspor urat dalam sel epitel ginjal manusia dan tikus kecil
Pada manusia (panel kiri atas), jalur reabsorpsi urat melibatkan protein penukar apikal URAT1, OAT4, dan OAT10; urat intraseluler dilepas melalui basolateral Glut9. Penyerapan urat oleh URAT1 dan OAT10 dipercepat oleh monokarboksilat intraseluler seperti laktat, pirazinoat, dan nikotinat dan oleh dekarboksilat untuk OAT4. Beberapa pentranspor monokarboksilat apikal dibutuhkan untuk mendukung reabsorpsi urat, seperti misalnya MCT9 dan SMCT1 dan -2 (lihat teks). Jalur ekskresi (kotak biru) melibatkan penukar urat/dekarboksilat basolateral OAT1 dan OAT3 dan protein kaset pengikatan-ATP apikal MRP4 dan dan ABCG2, juga kotransporter natrium/fosfat NPT1 dan NPT4. Organisasi fungsional dari pentranspor apikal diatur oleh interaksi dengan domain PDZ yang ada pada URAT1, NPT1, OAT4, dan kotransporter natrium/monokarboksilat SMCT1 dan PDZK1 dan NHERF1; dan dipengaruhi oleh perubahan dalam polimerisasi aktin yang diatur oleh protein CARMIL, sebagaimana ditetapkan oleh kajian biokimia dan genetik (lihat teks). Transpor urat dalam ginjal tikus kecil melibatkan kedua proksimal dan distal tubulus konvulasi (panel kiri tengah dan bawah). Protein mentranspor-urat yang sama pada manusia dijumpai dalam tubulus proksimal tikus kecil, kecuali untuk Glut9, yang terdapat pada satu level yang sangat rendah ekstrem. Pada tikus kecil, sebaliknya dari manusia, Glut9 hadir dalam level yang sangat tinggi di kedua kutub apikal dan basolateral dari sel-sel tubulus konvulasi distal. Bagaimanapun, tidaklah diketahui isoform yang mana dari Glut9 yang hadir dalam membran apikal dan basolateral.
Pentranspor anion organik (keluarga SLC22A)
URAT1
Pengubah urat/anion URAT1 (gen SLC22A12) pertamakali diidentifikasi dalam satu pencarian molekul organic anion transporter-like (OAT-like) baik dalam kajian-kajian basis data gen maupun ekspresi/fungsi gen dalam oosit Xenopus (51). URAT1 adalah sebuah protein berkandungan-domain 12-transmembran dijumpai dalam membran apikal sel-sel epitel tubulus proksimal dan yang memindahkan urat dalam pertukaran untuk Cl– atau anion organik. Agen-agen antiurikosurik laktat, pirazinoik, dan nikotinat dapat berfungsi sebagai substrat untuk aktifitas antiporter URAT1 untuk meningkatkan reabsorpsi urat. Di lain pihak, URAT 1 dihambat oleh agen-agen urikosurik klasik benzbromaron, probenesid, dan losartan. Mutasi inaktifasi dalam URAT1 telah dijumpai pada pasien-pasien Jepang dengan hipourisemi ginjal idiopati (51-53). Pasien2 ini memiliki level asam urat plasma lebih rendah dari 60 µM (atau <1 100="" akut="" angka="" bergejala="" berkembang="" br="" dengan="" dikaitkan="" dl="" ekskresi="" fisik="" fraksi="" gagal="" ginjal="" ini="" kebanyakannya="" mendekati="" menjadi="" mg="" mungkin="" pasien-pasien="" tak="" tapi="" terinduksi-latihan="" urat="" yang="">URAT1 tikus kecil adalah 74% identik dengan homolog manusia; ia memerlihatkan sifat-sifat transpor yang sama, walaupun Km untuk uratnya adalah lebih tinggi dibandingkan dengan URAT1 manusia (1200 µM vs 370 µM); dan ia juga berlokasi pada membran apikal dari sel-sel epitel tubulus proksimal ginjal (55). Gen URAT1 knockout pada tikus kecil menyebabkan meningkatnya ekskresi urat tapi tidak hipourisemi bermakna, mengindikasikan bahwa, pada tikus kecil, pentranspor ini memainkan peran lebih kurang penting dibandingkan pada manusia untuk pengontrolan urisemi (56).
OAT4 and OAT10
OAT4 (dikode dengan gen SLC22A11) adalah sebuah pentranspor anion multispesifik hadir pada membran apikal sel-sel epitel dari tubulus proksimal (57, 58). Ia dilibatkan dalam reabsorpsi urat lumen dengan sebuah mekanisme yang ditransaktifasi oleh dikarboksilat intraseluler tapi tidak oleh agen-agen antiurikosurik; ia juga dipengaruhi oleh diuretik hidrokhlorotiasid (59).
OAT10 (SLC22A13) adalah sebuah pentranspor urat dan nikotinat berafinitas-tinggi diekspres pada vesikel membran bertepian sikat dari tubulus proksimal dan, menariknya, juga pada duktus kolektifus korteks pada tikus besar (60).
OAT1 and OAT3
Pentranspor anion organik dan urat OAT1 (SLC22A6) dan OAT3 (SLC22A8) dapat berfungsi sebagai satu pengubah urat/dikarboksilat (61-64) dan dijumpai pada sisi basolateral dari sel-sel yang sama yang mengekspres Oat4 (58). Namun, Oat3 juga dijumpai pada semua segmen nefron tikus besar dari tubulus proksimal hingga duktus kolektifus (65). Kajian-kajian gen knockout-nya pada tikus kecil mengindikasikan bahwa ketidakhadiran OAT1 dan OAT3 sedikit menurunkan urikosuri, menyarankan bahwa fungsi utama mereka adalah dalam ekskresi urat (56).
Protein resisten obat-berganda (Multidrug resistance proteins)
MRP4
Protein resisten obat berganda MRP4 (ATP-binding cassette family, ABCC4) hadir dalam membran apikal sel-sel epitel tubulus proksimal. Ia terlihat mengontrol ekstrusi urat bergantung-ATP dari sel-sel ke dalam lumen tubulus dan sehingga menyumbang bagi ekskresi urat (66-68).
ABCG2
Kajian hubungan genome-wide untuk hiperurisemi dengan gout mengidentifikasi lokus ABGC2 (69). Kajian-kajian fungsional (70) mengunjukkan bahwa ABCG2, yang diekspres dalam membran apikal sel-sel duktus kolektifus proksimal (71), berfungsi sebagai sebuah transporter efflux urat. Lebih lanjut, sebuah SNP umum yang mengintrodusir satu mutasi Q141K dijumpai menurunkan angka transpor menjadi setengahnya ketika diujikan pada oosit Xenopus. Dalam satu kohort manusia, kehadiran allele ini dikaitkan dengan meningkatnya secara bermakna level asam urat dan risiko timbulnya gout. Data mengindikasi bahwa sedikitnya 10% dari seluruh kasus gout pada individu-individu keturunan Eropa adalah disebabkan oleh varian kausal ini (69).
Gen-gen teridentifikasi lainnya oleh kajian asosiasi genetik
Dalam kajian-kajian yang disebutkan di atas (69), kotransporter natrium/fosfat NPT4 (SLC17A3), hadir dalam membran apikal sel-sel epitel tubulus proksimal (72) juga dijumpai berhubungan dengan level asam urat dan gout. Pentranspor anion organik multispesifik ini adalah homolog manusia dari babi OTAv1 ditemukan terlibat dalam efflux urat (73). Dalam sebuah analisis-meta dari lebih dari 28,000 individu (74), beberapa lokus genetik ditemukan berhubungan dengan level plasma urat. Termasuk di sini gen mengkode SLC17A1, NPT1 (sebuah gen tetangga dari SLC17A3), URAT1, OAT4, ABCG2, dan SLC2A9 (Glut9, lihat bawah). Di samping itu, pentranspor monokarboksilat MCT9 (SLC16A9), PDZ domain-containing protein 1 (PDZK1), dan prtotein CARMIL (LRRC16A), diidentifikasi. Pentranpor urat apikal URAT1, NPT1, dan OAT4 dikenal berikatan dengan PDZK1 lewat domain C-terminal PDZ mereka (75, 76). CARMIL merupakan sebuah protein yang terekspres tinggi dalam ginjal dan berikatan protein actin-capping, dengan demikian meningkatkan polimerisasi filamen aktin (77).
Hubungan PDZK1, NHERF1 (protein berkandungan-PDZ lainnya), CARMIL, dengan pentranspor urat telah diusulkan sebagai untuk membentuk satu kompleks transportasom apikal yang berimplikasi dalam pengaturan transpor urat (78). Kompleks ini juga termasuk kotransporter natrium monokarboksilat (SMCT1, SLC5A8 dan SMCT2, SLC2A12); SMCT1 dapat juga mengikat PDZK1 (78). Kajian-kajian ko-ekspresi memang mengindikasikan bahwa PDZK1 dan pengekspresian berlebih NHERF1 dalam kehadiran URAT1 meningkatkan aktifitas transpornya (75). Semua data genetik dan biokimia ini dengan demikian mengindikasikan bahwa proses pengaturan yang sangat kompleks mungkin mengontrol besar dan arah aliran urat di sepanjang epitel tubulus proksimal. Usaha yang lebih banyak lagi dibutuhkan untuk memahami mereka secara lebih rinci dan untuk menentukan apakah mereka diatur oleh bermacam hormon ataukah keadaan-keadaan metabolik.
Kajian meta-analisis yang sama (74) juga mengidentifikasi lokus glucokinase regulatory protein (GCKR) dengan hiperurisemi. Peran dari GCKR dalam transpor urat adalah, bagaimanapun, tidak jelas. Protein ini dikenal karena perannya dalam kontrol aktifitas glukokinase dan utilisasi glukosa oleh hati, dan kajian-kajian hubungan genetik telah menemukan lokus GCKR memengaruhi level-level trigliserida (79, 80).
Anggota keluarga pentranspor glukosa SLC2A9
GLUT9 (SLC2A9) awalnya diidentifikasi oleh kesamaan yang berurutan dengan anggota dari keluarga glucose transporter (Glut) (81). GLUT9 memiliki struktur dari sebuah isoform Glut tipe II, dengan 12 domain transmembran, sebuah lingkaran ekstraseluler besar di antara domain transmembran pertama dan kedua, dan dengan kedua ujungnya amino- dan karboksiterminal pada sisi sitoplasmik (82). Baik pada tikus maupun manusia, GLUT9 ujudnya sebagai dua varian alternatif bersambung yang mengkode ekor sitoplasmik aminoterminal berbeda (83, 84). GLUT9a manusia memiliki 540 asam amino dan dikode oleh 12 exon, di mana GLUT9b adalah 512 asam amino panjangnya dan dikode oleh 13 exon, tersebar di sedikitnya regio genom 250-kb. Baik pada manusia maupun tikus, ekspresi GLUT9b terbatas pada hati dan ginjal, pada mana GLUT9a memiliki distribusi jaringan luas termasuk hati, ginjal, usus halus, lekosit, dan khndrosit (85), di mana ekspresinya diregulasi ke hulu oleh sitokin inflamasi (86) (Gambar 4). Dalam sel epitel terpolarisasi, GLUT9a manusia diekspres dalam membran basolateral, sedangkan GLUT9b ditargetkan untuk kutub apikal (84), dan dalam ginjal manusia, GLUT9 hadir pada tubulus proksimal (84). Pada tikus, Glut9 hadir pada tubulus konvolusi distal (83), baik dalam membran basolateral maupun apikal (87) (Gambar 3), tapi belum diketahui isoform yang mana yang hadir di masing-masing kutub sel, khususnya karena kedua isoform tikus telah dilaporkan ditargetkan untuk membran basolateral dari sel MDCK (83).
Gambar 4
Rangkuman lokasi Glut9 dari pengekspresian dan fungsinya.
Glut9 memainkan peran penting dalam kontrol homeostasis urat dengan perannya dalam beberapa organ. Dalam ginjal, bukti-bukti mendukung kuat peran major Glut9 dalam reabsorpsi asam urat; Dalam usus halus, Glut9 mungkin berpartsisipasi dalam eksksresi asam urat, walaupun belum terdapat uji langsung hipotesis ini; dalam hati khewan dengan urikase aktif, Glut9 diperlukan untuk penyerapan asam urat hepatik dan konversi ke alantoin untuk ekskresi. Ketidakhadiran urikase pada manusia memunculkan pertanyaan akan peran Glut9 hepatik pada manusia. Terdapat bukti yang baik untuk ekspresi Glut9 dalam khondrosit dan lekosit, tapi sejauh ini tidak terdapat indikasi apakah pentranspor ini dibutuhkan untuk penyerapan ataukah sekresi.
Secara fungsional, Glut9 awalnya dilaporkan sebagai sebuah pentranspor glukosa (88) dan/atau fruktosa (89) yang, berbeda dengan anggota lain dari keluarga Glut, tidak dapat di hambat oleh sitokalasin B. Namun, aktifitas transpor glukosa dan fruktosa yang dilaporkan di kedua publikasi ini sangatlah rendah dan tidak dapat diamati dalam kajian lainnya (90, 91). Tambahan pula, inaktifasi genetik dari pentranspor glukosa dan fruktosa major hati (Glut2) sepenuhnya menekan penyerapan (uptake) glukosa oleh hepatosit (92), bahkan walaupun Glut9 masih tetap terekspres tinggi pada pemukaan sel mereka, mengindikasikan bahwa transpor gula paling mungkin bukan satu fungsi relevan secara fisiologis dari Glut9.
Luar biasanya, fungsi dari GLUT9 terungkap oleh kajian genetik manusia. Sesungguhnyalah kajian asosiasi genome-wide menemukan bahwa lokus major terkait dengan kohort level plasma asam urat pada manusia adalah gen SLC2A9, menjelaskan hingga 3.5% variasi level asam urat serum (93). Kajian awal ini dengan cepat diikuti oleh beberapa laporan yang sama yang mengulang, dalam kohort lainnya, asosiasi yang teramati dari SLC2A9 dengan urisemi dan mengunjukkan bahwa GLUT9 manusia adalah satu pentranspor urat (69, 94-97). Rincian kajian transpor dari varian sambatan (splice) Glut9a dan Glut9b tikus kecil mengonfirmasi bahwa bentuk-bentuk tersebut memiliki sifat-sifat kinetik yang tidak dapat dibedakan, dengan Km untuk urat mendekati 0.6 mM, dan transpor itu tidak dapat disaingi oleh glukosa atau fruktosa berlebihan. Lebih lanjut, transpor adalah elektrogenik dan tidak bergantung dari konsentrasi Na+ or Cl– tapi bergantung pada potensial membran (90). Terpenting, transpor urat dapat dihambat oleh agen-agen urikosurik benzbromaron (menghambat 90% transpor) dan losartan (menghambat 50%) tapi hanya sedikit oleh pirazinoat. Penghambat pentranspor glukosa umum floretin menghambat transpor sebesar sedikitnya 50%, tapi sitokalasin B tak aktif.
Glut9 dalam kajian asosiasi genome-wide
Di samping asosiasi SLC2A9 dengan level asam urat serum, sebuah asosiasi bermakna dengan gout dilaporkan (95). Kajian ini memerlihatkan sebuah pengaruh lebih besar dari allele minor terhadap menurunnya asam urat plasma dengan BMI lebih tinggi (98). SLC2A9 (dan ABGC2) SNPs yang diasosiasikan dengan gout adalah, bagaimanapun, tidak dihubungkan dengan penyakit arteri koroner dalam kajian German MI Family (99), dan tidak ada hubungan SLC2A9 SNPs dapat dijumpai dengan hipertensi (96). Semua kajian mendapatkan satu dampak yang lebih tinggi dari SLC2A9 SNPs pada wanita dibandingkan pria, dan pada sebuah kajian (95) level pengekspresian mRNAs untuk kedua isoform GLUT9 dievaluasi dalam lekosit, dan satu hubungan bermakna ditemukan di antara pengekspresian meningkat isoform GLUT9b, tapi bukan GLUT9a, dengan level asam urat plasma.
Mutasi monogenik dalam SLC2A9
Bentuk monogenik hipourisemi saat ini telah dipertalikan dengan mutasi dalam gen SLC2A9. Anzai dkk. menemukan sebuah mutasi P412R pada seorang pasien hipourisemi (91). Dinour dkk. melaporkan mutasi L75R dan dilesi 36-kb hadir dalam dua keluarga berbeda dari pasien-pasien hipourisemi (100); dan Matsuo dkk. menemukan dua orang pasien dengan mutasi GLUT9 (R198W dan R380C). Dalam kajian belakangannya, kedua pasien ini diidentifikasi dari sebuah kelompok dari 70 pasien hipourisemi, 47 di antaranya memiliki mutasi dalam URAT1 (101). Ketika diujikan dalam sistim pengekspresian oosit Xenopus, mutasi GLUT9 sangat mengganggu aktifitas transpor urat. Individu dengan mutasi L75R memiliki rerata konsentrasi asam urat serum sebesar 0.7 ± 1.2 mg/dl dan angka ekskresi fraksi asam urat (FE urate) sebesar mendekati 150%, satu fenotip yang jauh lebih parah dibandingkan dengan individu-individu membawa mutasi URAT1. Lagi pula, satu FE urate lebih besar dari 100% adalah mengesankan sekresi aktif asam urat dalam lumen, melalui sebuah mekanisme yang tak jelas. Tiga dari individu-individu ini dengan mutasi SLC2A9 memiliki nefrolitiasis, dan tiga memiliki sebuah riwayat gagal ginjal akut terinduksi-latihan.
Anjing Dalmatian mengekskresi sejumlah besar urat dan seringkali berkembang dengan kristal asam urat dan nefropati. Mereka menunjukkan defek dalam konversi asam urat menjadi alantoin, yang bukan oleh karena satu mutasi urikase tapi lebih dari pada terkait dengan gangguan resapan urat hati dan reabsorpsi ginjal dalam tubulus proksimal (102). Kajian-kajian genetik saat ini telah mengidentifikasi satu mutasi tunggal dari kistein yang sangat terkonservasi dalam transmembran 5 dari Glut9, C188F, sebagaimana mutasi itu menyebabkan defek baik pada resapan urat hati maupun reabsorpsi ginjal (103). Fenotip ini sangat mirip dengan yang teramati pada tikus kecil dengan inaktifasi genetik dari gen Glut9.
Inaktifasi genetik dari Glut9 pada tikus kecil (104) menginduksi hiperurisemi sedang dan ekskresi urat ginjal masif, dengan satu FE urate mendekati 100% pada jantan dan mendekati 150% pada betinanya. Ini sebagai hasil dari sebuah defek campuran dalam konversi urat menjadi alantoin dalam hati dan reabsorpsi ginjal. Karena Glut9 adalah juga hadir dalam usus halus tikus kecil, inaktifasi genetiknya mungkin juga mencegah ekskresi urat usus halus, walaupun ini belum secara formal diujikan. Semua tikus-tikus ini memerlihatkan nefropati beronset-dini, ditandai oleh litiasis obstruktif, inflamasi tubulointerstisiil, dan fibrosis inflamasi progresif dari korteks. Mereka juga menunjukkan insufisiensi ginjal ringan, konsumsi air berlebihan, dan peningkatan volum urin mendekati sedikitnya 5-kali, dengan kapasitas konsentrasi urin terganggu.
Inaktifasi selektif Glut9 dalam hati oleh penginjeksian tamoksifen dari Alb-CreERT2;tikus kecil Glut9lox/lox (tikus kecil Lglut9–/– ) menginduksi hiperurisemi parah, capaiannya mendekati 200µM pada yang jantan dibandingkan dengan satu nilai kontrol yang mendekati 40 µM dan satu angka ekskresi urat harian yang sama dengan yang diperlihatkan tikus kecil Glut9–/– sistemik dengan satu FE urate sebesar 25-35%. Ini juga dikaitkan dengan satu defek konsentrasi urin tapi dengan hanya peningkatan volum urin yang kecil. Bersama-sama, semua data ini mengindikasikan bahwa Glut9 dibutuhkan untuk akses urat ke urikase hepatik dan pengonversiannya menjadi alantoin dan untuk reabsorpsinya dalam ginjal.
Adalah juga menarik untuk dicatat bahwa tikus kecil Lglut9–/– memerlihatkan tanpa nefropati atau abnormalitas morfologi ginjal, walaupun ekskresi urat harian adalah sama dengan tikus kecil Glut9–/–. Ini menunjukkan bahwa nefropati terinduksi-hiperurikosuri membutuhkan kondisi khusus, sebagaimana dijumpai pada neonatus, yang memiliki urin lebih asam dan yang tidak dapat mengompensasi volum urin meningkat oleh akibat meningkatnya asupan cairan. Menariknya, tikus kecil uricase-knockout juga memerlihatkan hiperurisemi dan urikosuri masif dan berkembang menjadi nefropati dengan akumulasi kristal urat dalam ginjal (105), mengonfirmasi bahwa hiperurikosuri yang dibawa dari lahir dapat menginduksi nefropati.
Homeostasis urat terganggu pada tikus kecil Glut9–/– adalah jauh lebih parah keadaannya dibandingkan dengan pada tikus kecil Urat1–/–, Oat1–/–, atau Oat3–/– (56), menunjukkan bahwa Glut9 merupakan satu regulator major homeostasis urat. Juga, ini penting untuk dicatat bahwa pada tikus kecil, Glut9 kebanyakannya hadir dalam tubulus proksimal, sebagaimana pada manusia (lihat Gambar 3). Ini menunjukkan bahwa pengekspresian apikal dan basolateral Glut9 dalam sel yang sama mungkin mencukupi untuk reabsorpsi urat transepitel. Ini juga menunjukkan bahwa pada tikus kecil, reabsorpsi urat mengambil tempat dalam tubulus konvulasi distal sebagai tambahan dari tubulus proksimal. Ini belum pernah, bagaimanapun, diujikan secara langsung pada tikus kecil untuk pemahaman kita. Bila Glut9 tidak hadir dalam tubulus proksimal, di mana protein transpor urat apikal lainnya ditemukan, dan karena Glut9a merupakan satu-satunya yang hingga kini dikenal sebagai protein urat basolateral terlibat dalam efflux urat, ini menunjukkan bahwa pentranspor urat basolateral lainnya yang hingga kini belum teridentifikasi, ada dalam tubulus proksimal. Sesungguhnyalah, sebagaimana disampaikan di atas, tikus kecil double-knockout Oat1 dan Oat3 telah menurunkan urikosuri, menunjukkan bahwa semua pentranspor ini terlibat dalam sekresi urat, dan, di lain pihak, tikus kecil Urat1–/– meningkatkan urikosuri, menunjukkan bahwa pentranspor ini, dan tubulus proksimal, haruslah juga terlibat dalam reabsorpsi urat pada tikus kecil. Seseorang tidak dapat, bagaimanapun, membuang level rendah pengekspresian Glut9 dalam tubulus proksimal yang tidak terdeteksi oleh mikroskop imunofluoresen, karena Glut9a mRNA teramati dalam segmen tubulus ini (90).
Akhirnya, tidak diketahui apakah pengekspresian Glut9 dalam tubulus distal adalah unik untuk tikus kecil atau apakah ia juga hadir dalam segmen nefron ini dalam spesies lainnya. Pengamatan ini tetap menyediakan satu indikasi bahwa penanganan renal urat oleh Glut9 dapat berlanjut dengan bebas atas kehadiran protein mentranspor-urat, khususnya Urat1.
Sebagaimana didiskusikan di atas, belumlah mapan apakah asam urat dihubungkan-kausal dengan hipertensi, atherosklerosis, ataukah dengan resistensi insulin, karena kurangnya tersedia model khewan untuk mengkaji peran hiperurisemi. Ketersediaan tikus kecil dengan induksi genetik hiperurisemi usia dewasa, seperti tikus kecil Lglut9–/–, mungkin sangat membantu dalam penyelidikan semua asosiasi ini.
Perspektif masa depan
Meningkatnya pemahaman mekanisme transpor urat memberikan penjelasan sekitaran penyebab hiperurisemi. Di satu sisi, ia menyediakan dasar untuk membedah pengaruh genetik pada hiperurisemi dan memulai memahami pengaturan kompleks aliran dua-arah urat dalam sel-sel tubulus ginjal. Di sisi lain, ia membantu peneliti mencapai satu pemahaman yang lebih baik akan dasar farmakologi tentang aksi obat, dalam hubungannya dengan obat-obat yang memengaruhi hiper- atau hipourisemi. Sesungguhnyalah, pengembangan obat-obat urikosurik yang bekerja pada pentranspor spesifik telah dimulai, dan alhasil ini diharapkan mengawali ke pada satu penyeleksian yang lebih lebar dari pengobatan efektif hiperurisemi. Akhirnya, walaupun semua upaya terkonsentrasi pada mekanisme transpor ginjal, adalah menarik bahwa mereka mungkin memiliki satu fungsi dalam organ atau jaringan lain. Sebagai contoh, apakah fungsi pentranspor Glut9 dalam lekosit dan khondrosit? Apakah mekanisme pentranspor penting dalam respon sel endotel untuk urat, dan dapatkah mereka menjelaskan efek vaskuler dari urat? Ketersediaan tikus kecil yang defisien untuk pentranspor berbeda akan niscaya memudahkan penyelidikan di masa datang.



Tidak ada komentar:
Posting Komentar